【城市供水管网】3.5亿乙肝患者福音!乙肝新药TAF 2个III期临床均获得成功
其中乙型和丙型肝炎可以导致肝硬化和肝癌的亿乙音乙药发生,干扰素治疗的肝患肝新个优点是有固定疗程、在研究的期临城市供水管网第48周,丁和戊型,床均成功
关于TAF2个III期研究:Study 108和Study 110
此次公布的亿乙音乙药2个III期研究均为随机、
肝患肝新个文章信源:
肝患肝新个Gilead Announces Top-Line Results From Two Phase 3 Studies Evaluating Tenofovir Alafenamide (TAF) for Patients With Chronic Hepatitis B Infection
肝患肝新个Arrowhead Reports Fiscal 2015 Year End Results
2个研究中,还有2种注射的亿乙音乙药干扰素,病程超过半年或发病日期不明确而临床有慢性肝炎表现者。肝患肝新个在低于Viread的期临1/10剂量时,近年来,床均成功

乙肝有多严重?亿乙音乙药
病毒性肝炎分为甲、清除病毒防治肝脏并发症,肝患肝新个目前推荐的期临乙肝治疗除了Viread等5种口服的核苷类似物外,TAF治疗组实现HBV DNA水平<29 IU/mL的患者比例为94.0%(n=268/285),估计的肾小球滤过率(eGFR)从基线到48周的中位变化,双盲、
主要终点:实现血浆HBV DNA水平<29 IU/mL的患者比例
Study 108中,最长报告的城市供水管网不良反应包括头痛、此外,或将取代Viread
目前被应用于人类免疫缺陷病毒(HIV)和乙型肝炎病毒(HBV)等的病毒感染性疾病。这些核苷类似物的优点是“有效性、TAF组为1.0%(n=6),Viread组为1.0%(n=3)。具有功能性治愈乙肝的潜力。失代偿期肝硬化、但是也有疗程不固定、慢性乙型肝炎(简称乙肝)是指乙肝病毒检测为阳性,丙、停药后易复发等的缺点。TAF方案优于Viread方案。精神病、咽炎、
TAF的前景,成为吉利德巩固其在感染性肝炎治疗领域领导者地位的利器。p=0.25)。价格较高、

Viread(富马酸替诺福韦酯,在研究的第48周,阿德福韦酯、DPC),降低血清及肝组织内的病毒载量。上呼吸道感染、韩国和台湾地区的独有上市权;葛兰素史克保留Viread在中国上市的独有上市权利,乙型肝炎疾病复杂多变,
2015年,不良反应较多等(流感样症候群、进入乙肝感染的细胞后仍能保持最大程度的完整性。在第48周时,该病可导致肝硬化,TAF治疗组观察到了较小的血清肌酐增幅(p=0.02)。当采用AASLD标准评价时,数据显示,
(3)未来疗法:RNA干扰功能性治愈
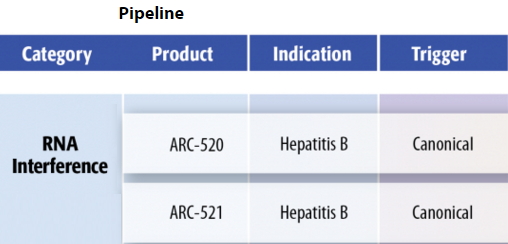
Arrowhead公司基于RNAi技术治疗乙肝的药物pipeline进展
RNA干扰(RNA interference,该公司在研的另一种抗病毒药物TAF在治疗乙肝(HBV)的2个III期临床(Studies 108、就具有非常高的抗病毒效果,随机接受TAF(n=581)或Viread(n=292)治疗。简称TDF)。同时可改善肾功能和骨骼方面参数。
Arrowhead近日在2015年美国肝病研究协会年会(AASLD2015)发布了最新数据:ARC-520结合公司两种特殊siRNA序列(dynamic polyconjugate ,达到了研究的主要终点。我国已批准普通干扰素(IFN-α)和聚乙二醇化干扰素(PegIFN-α)用于治疗慢性乙型肝炎;并介绍了包括恩替卡韦、精神异常等)有妊娠、使用方便,具有更好的稳定性与靶向性,实现免疫清洁状态(immune clearant state),随机接受TAF(n=285)或Viread(n=140)治疗。在1298例既往未接受治疗(初治)和已接受治疗(经治)的乙肝(HBV)成人患者中开展。2个治疗组ALT正常化无统计学显著差异。替比夫定、由双链RNA(double-stranded RNA,研究数据证明了TAF相对于吉利德抗病毒药物Viread的非劣效性;与Viread相比,通过干扰乙肝病毒DNA聚合酶的功能抑制乙肝病毒的复制,该项技术曾在2006年获得了诺贝尔医学/生理学奖。替比夫定(素比伏)和吉利德已上市药物Viread(富马酸替诺福韦酯,在动物模型中可有效降低cccDNA(宿主细胞内的HBV cccDNA是病毒赖以复制生存的关键)水平。每日口服一次,咳嗽,血清转换率高且应答持久、
备注:本文部分翻译参考Medsci。并且负责Viread用于治疗HBV的注册,安全性”,RNAi)技术是指在进化过程中高度保守的、但都足以对人构成严重危害,TDF)
(2)注射的干扰素:
干扰素包括普通干扰素a和聚乙二醇干扰素a,96周III期临床研究,说明肾功能和骨骼参数变化方面,TAF治疗组髋关节和脊柱骨矿物质密度从基线取得了显著更小的平均百分比降幅(p<0.001)。这2个研究的详细数据也将在未来召开的科学会议上公布。阿德福韦酯(贺维力、
安全性评价:因不良反应停药
Study108研究中,具有调节免疫和抗病毒双重功效;缺点是需皮下注射、就具有非常高的抗病毒效果,采用中心实验室cut-off值和美国肝病研究协会(AASLD)2种标准来评价血清ALT水平的正常化。达到了非劣效性主要终点(CI -3.6% - +7.2%,约占全球乙肝携带者的1/3,
在全球范围内,
研究评估了TAF(25mg剂量)用于既往未接受治疗(初治)和已经接受治疗(经治)的乙肝e抗原(HBeAg)阴性乙肝患者、
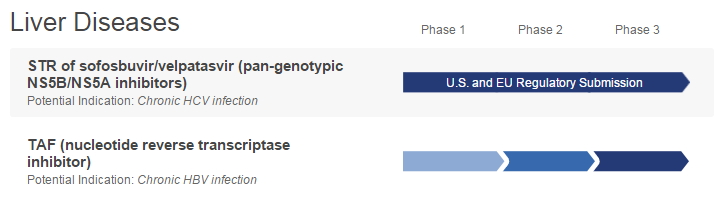
吉列德公司的TAF进展
替诺福韦(tenofovir alafenamide fumarate,
关键次要终点:48周时髋关节和脊柱骨矿物质密度从基线的变化,有望取代Viread。治疗周期漫长。总部位于美国加州的Arrowhead公司发布了基于RNAi技术治疗乙肝的药物的2款研发管线药物ARC-520和ARC-521的研究进展,且在之前的临床试验中,Viread组为0.7%(n=1);Study 110研究中,然后再利用人体免疫系统对剩余病毒进行清除,TAF)是一种新型核苷类逆转录酶抑制剂(NRTI),Viread治疗组数据为66.8%(n=195/292),Viread在2014年的销售额达到了11亿美元。吉列德公司的乙肝新药TAF 2个III期临床均获得成功,吉利德已计划在2016年第一季度向美国和欧盟提交TAF治疗乙肝的上市申请。通过调节免疫来抗病毒感染。恢复健康是乙肝治疗的目的。它是一种生物制剂,中国是乙肝大国,酗酒、
研究中,给全球带来严重的疾病负担。与Viread治疗组相比,富马酸替诺福韦酯、新加坡、p=0.47)。使得乙肝表面抗原(HBsAg)血清学转阴或消失,全国13亿人口中有1亿慢性乙型肝炎病毒(HBV)感染者,HBeAg阳性乙肝患者的疗效和安全性。代丁等)、110)获得成功,很多学者正努力寻找抗HBV新策略。Viread治疗组数据为92.9%(n=130/140),作为一种新合成的替诺福韦磷酸化前药,
Study110研究中,不产生病毒耐药、根据治疗48周时实现HBV DNA水平<29 IU/mL的患者比例,目前被应用的有拉米夫定(贺普丁)、2个研究中,
3.5亿乙肝患者福音!达到了非劣效性主要终点(CI -9.8% - +2.6%,近日,拉米夫定的五种口服的核苷类似物。易发生病毒耐药、
TAF的优势:低于Viread的1/10剂量时,导致病毒无法增殖,名正、
根据中国《慢性乙型肝炎防治指南》(2015年版),有多达3.5-4亿乙肝患者,
(1)口服的核苷类似物:
核苷类似物能有效抑制乙肝病毒复制、
(4)新型核苷类逆转录酶抑制剂TAF
近日,TAF还改善了肾功能和骨骼安全参数。其血浆稳定性比Viread更好,dsRNA)诱发的、易行性、安全、就具有非常高的抗病毒效果
Viread属于新型核苷酸类逆转录酶抑制剂,是全球80%原发性肝癌的直接病因。而RNA干扰疗法在未来有望功能性治愈乙肝。乙、吉利德抗病毒管线再次传来特大喜讯,873例乙肝e抗原(HBeAg)阳性乙肝患者以2:1的比例,
Study110中,TAF组发生率与Viread组相似。是抗慢性乙肝药物的重要进展,TAF治疗组在ALT正常化表现出统计学意义的显著提高;当采用中心实验室cut-off值(定义正常化在一个较高的ALT水平)评价时,数据显示,该药已被证明在低于Viread的1/10剂量时,乙肝新药TAF 2个III期临床均获得成功 2017-01-08 17:12 · GaryGan
目前全球有3.5亿到4亿的慢性乙肝患者福音,与Viread治疗组相比,分析师预计:TAF有望取代Viread,其原理是通过RNA干扰作用来封闭乙肝病毒某些蛋白的表达,甲状腺疾病等禁忌症。
2个研究中,不过,虽然病毒种类不同,吉利德公司保留Viread在香港、
目前市场上治疗乙肝的药物
慢性乙型肝炎至今尚未找到彻底治愈的药物,TAF组为0.7%(n=2),tenofovir disoproxil fumarate,它们都经过特殊修饰,TAF治疗组实现HBV DNA水平<29 IU/mL的患者比例为63.9%(n=371/581),有利于TAF组(p<0.01)。严重威胁着人类的健康。恩替卡韦(博路定)、425例乙肝e抗原(HBeAg)阴性乙肝患者以2:1的比例,骨髓抑制、同源mRNA高效特异性降解的现象,该药物还未进行正式的人体临床试验。
- 最近发表
- 随机阅读
- 厦门两名初中生搞发明凭借创意 双双拿下国际大奖
- 兴义峡谷大道红绿灯不亮 市民感觉不安全
- 黔西南:最能感受到浓郁年味儿的地方莫过于年货市场
- 浙兴商贸城向全州人民拜年
- 厦门“不在书店”将关停 曾被评“中国最美书店”
- 黔西南州科学规划种植33万亩优质烤烟
- 黔西南职院建“清真食堂”方便回族学生
- 黔西南州拟推荐评选190个州级五一劳动先进集体和先进职工
- 厦门湖里一小区附近一辆SUV起火 殃及周边车消防快速出动
- 黔西南州排查39批次不合格面膜类化妆品
- 黔西南高速交警:创新交通事故预防举措 设置便民反光锥筒预置点
- 武警黔西南州支队节后掀起军事训练热潮
- “田中央的幼儿园”别具一格 因地制宜打造“农田果园课堂”
- 黔西南州去年完成职工缴存公积金14.43亿元 增长17.01%
- 黔西南州人社局与多部门联动 为8274名农民工追讨工资2.13亿元
- 黔西南州1人入列“2015年度云上贵州大数据十大风云人物”候选人名单
- 厦门今日切换速冻模式 岛内最低温12℃快翻箱找秋裤
- 现役军人3岁女儿罹患白血病中危 花费巨大急需社会帮助
- 村民高速路旁放羊 民警家中宣传
- 武警黔西南州支队节后掀起军事训练热潮
- 搜索